キネシンの動作機構を解明 〜BL-6Aを用いた結晶構造解析〜
2004年8月5日
東京大学大学院医学研究科の仁田亮(にった りょう)助手および廣川信隆(ひろかわ のぶたか)教授のグループは,PFのBL-6Aにおいて,キネシンスーパーファミリータンパクのひとつであるKIF1AがATPを加水分解する中間状態を含めた結晶構造解析を行ったことにより,キネシンの微小管上での動作機構を構造生物学的に明らかにする事に成功しました。
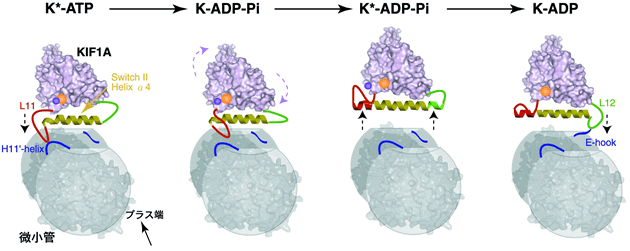
キネシンは,微小管上を動いて細胞内物質輸送を担っている輸送タンパク質で,ATPの加水分解のエネルギーを用いて微小管上を動いていますが,どのようにATPの化学的エネルギーを力学的エネルギーに変換して動いているのかは明らかになっていませんでした。今回,キネシンがATPを加水分解する中間状態の構造も含めた結晶構造解析を行ったことによって,キネシンKIF1Aの構造中に,加水分解の途中で大きく構造を変える部分があることがわかりました。この構造変化をする部分に含まれる2つのループ状の構造が,交互に微小管に結合・解離を繰り返すことによって,微小管上を目的方向に進んで行く動作機構が明らかになりました(下図)。
この研究成果は2004年7月30日発行のScience誌で発表されたものです。
R. Nitta, M. Kikkawa, Y. Okada and N. Hirokawa : KIF1A Alternately Uses
Two Loops to Bind Microtubules. Science, 305, 678-683 (2004).