関節リウマチ関連タンパク質(PAD4)の構造解析に成功
2004年8月18日
横浜市立大学の佐藤衛(さとう・まもる)教授の研究グループ(有田恭平、中島克彦、橋本 博、清水敏之、山田道之、佐藤
衛)は、PF-AR NW12およびSPring-8の放射光X線を用いて、関節リウマチの原因遺伝子から作られるタンパク質、ペプチジルアルギニン・デイミナーゼ4(PAD4)の構造解析に成功しました。
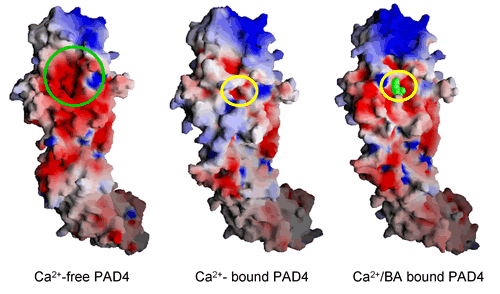
PADはCa2+イオン存在下でタンパク質中のアルギニン残基をシトルリン残基に変換する酵素で、今回の構造解析によってCa2+イオンの結合部位や基質結合部位を含む酵素の全容が詳細に明らかとなりました。その結果、PAD4の活性部位はCa2+イオンがないときわめて不安定で大きく揺らいでいますが、Ca2+イオンが結合すると安定化され、特徴的な活性部位の構造が誘起されることが示されました。さらに、Ca2+イオンの結合によって誘起された活性部位の溝に基質分子が結合することも示され、これまでにはないまったく新しいCa2+イオンによる酵素の活性化機構が見つけ出されました。また、PAD4遺伝子の一塩基多型は関節リウマチ(RA)の発症と強い相関があることより、PAD4の阻害剤はRAの根本的な治療薬になるものと期待されます。したがって、今回明らかにされたPAD4の構造やCa2+イオンによる酵素の活性化機構は酵素阻害剤の開発にはきわめて重要であり、今回の構造解析の結果は国内外の製薬企業から注目されています。
この研究成果は,2004年8月(オンライン版は7月11日)発行のNature Structural and Molecular Biology
で発表されたものです。
K. Arita, H. Hashimoto, T. Shimizu, K. Nakashima, M. Yamada and M. Sato
: Structural basis for Ca2+-induced activation of human PAD4.
Nature Structural and Molecular Biology, 11, 777-783 (2004)