インターフェロンによる抗ウイルス機構の解明に迫る
〜新しい抗ウイルス薬剤の創薬を目指して〜
2004年10月6日
昭和大学薬学部の田中信忠(たなか・のぶただ)博士(タンパク3000プロジェクト「翻訳後修飾と輸送」班員),中村和郎(なかむら・かずお)教授のグループは,岐阜大学工学部の中西雅之(なかにし・まさゆき)博士、北出幸夫(きたで・ゆきお)教授と共同で,PFのAR-NW12を用いて,インターフェロンにより誘導される抗ウイルス機構の解明に迫る構造生物学的知見である,ヒトRNase LのN末端2-5A結合ドメインと2-5Aとの複合体の構造解析に成功しました。
インターフェロンによって誘導される抗ウイルス機構のひとつ「2-5Aシステム」では,核酸の一種2-5A(2',5'結合オリゴアデニル酸)が,RNase Lの活性化を引き起こし,ウイルスのmRNAを分解しタンパク質合成を阻害することにより、ウイルスの増殖が抑制されます。生体内では2-5Aはインターフェロンによって誘導される2-5A合成酵素によって合成されますが,RNase Lの立体構造情報,およびRNase Lと2-5Aの結合様式が解明されたことで,新しい抗ウイルス薬(インターフェロンを介さずに直接RNase Lを活性化する作用機構)のドラッグデザインの可能性が拓けました。
この研究成果はEMBO Journal(オンライン版は2004年9月23日発行)で発表されたものです。
Nobutada Tanaka, Masayuki Nakanishi, Yoshio Kusakabe, Yoshikuni Goto, Yukio Kitade and Kazuo T. Nakamura : Structural basis for recognition of 2',5'-linked oligoadenylates by human ribonuclease L. EMBO Journal, in press.
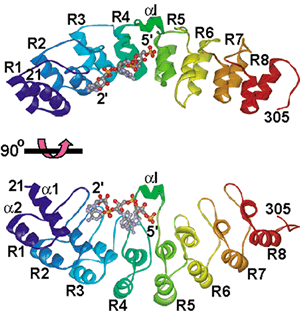
RNase LのN末端のアンキリンリピートドメインと,2-5Aとの複合体のリボン図
(2-5Aはball-and-stickモデル)。