SUMO化による構造変化がタンパク質の機能をスイッチ
〜SUMO化したチミンDNAグリコシラーゼの構造解析に成功〜
2005年6月17日
京都大学大学院工学研究科の白川昌宏(しらかわ・まさひろ)教授のグループは、PFのBL6Aを用いて、ユビキチン様タンパク質SUMO(スモ、Small ubiquitin-like modifier)が結合したDNA修復タンパク質、チミンDNAグリコシラーゼの構造解析に成功しました。
SUMOは、ユビキチンと同様に化学的にタンパク質と結合することにより、そのタンパク質の機能を調節する働きを持つ小さなタンパク質です。白川教授のグループは、SUMOが結合した(SUMO化した)ことにより、チミンDNAグリコシラーゼのDNA結合部位の近くに大きく構造が変化している部分を発見しました。この部分がチミンDNAグリコシラーゼに結合しているDNAを弾き飛ばすように外す機構が考えられ、この構造変化により次に働く酵素にDNAを受け渡している巧妙な仕組みを見いだしました。この研究は、SUMO化がタンパク質の立体構造の変化によって機能変換を行うという新しい調節機構を示唆するものであり、多くのタンパク質で起こる共通のメカニズムである可能性があります。
この研究成果は2005年6月16日発行のNature誌に掲載されました。
Daichi Baba, Nobuo Maita, Jun-Goo Jee, Yasuhiro Uchimura, Hisato Saitoh,
Kaoru Sugasawa, Fumio Hanaoka, Hidehito Tochio, Hidekazu Hiroaki and Masahiro
Shirakawa : Crystal structure of thymine DNA glycosylase conjugated to
SUMO-1. Nature, 435, 979-982 (2005).
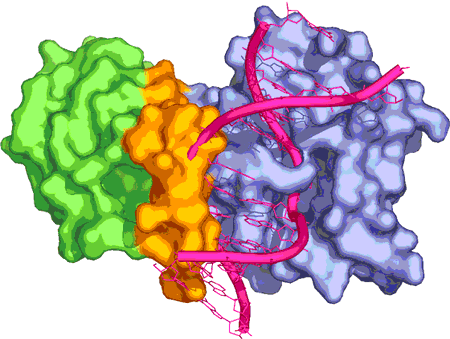
SUMO化されたチミンDNAグリコシラーゼとDNAとの複合体構造のモデル。SUMO(緑)が結合することにより、チミンDNAグリコシラーゼの一部(オレンジ)が大きな立体構造の変化を起こし、結合したDNA(赤)と立体衝突を起こしている。
6月23日のNews@KEKでこの研究が紹介される予定です。
by pfw3-admin@pfiqst.kek.jp