細胞質から核内へのタンパク質輸送
−核内輸送受容体の構造解析で輸送メカニズムを解明−
2007年10月19日
横浜市立大学大学院国際総合科学研究科の佐藤 衛(さとう まもる)教授の研究グループ(今崎 剛博士、清水敏之准教授、橋本 博助教、日高雄二近畿大学准教授、小瀬真吾理化学研究所専任研究員、今本尚子理化学研究所主任研究員、山田道之名誉教授)は、核内輸送受容体(トランスポーチン)と核内に輸送されるタンパク質の核局在ペプチドとの複合体のX線結晶構造解析に成功し、核内輸送受容体による細胞質から核内へのタンパク質の輸送機構を明らかにしました。
高等動植物の遺伝情報(DNA)は細胞の核内に局在しており、そこではDNAの複製や転写・修復・組換・修飾、さらにはDNAに結合したヒストンの化学修飾など生命の維持や活動に必要な多くのタンパク質が働いています。しかしながら、タンパク質は細胞質で作られますので、核内で働くタンパク質は細胞質から核内へ輸送される必要があります。細胞質で作られて核内に輸送されるタンパク質には、核内で働くタンパク質であることを示す荷札(核局在化ペプチド)が付加されており、この荷札を核内輸送受容体と呼ばれるタンパク質が認識して核内に輸送されていきます。しかしながら、核内に輸送されるタンパク質は様々で、それに対応して多くの荷札が存在しますので、このような荷札がどのように核内輸送受容体に認識され、そして、核内に輸送された後、どのように核内輸送受容体から解離されるかは、これまで実験的に明らかにされていませんでした。
研究グループでは、ヒト由来の核内輸送受容体(トランスポーチン)について、トランスポーチン単独および相互作用の異なる3種類の輸送タンパク質の核局在化ペプチド(荷札)との複合体のX線結晶構造解析をPFのAR-NW12AおよびSPring-8のBL-41XUを用いて行い、輸送タンパク質が結合することによる核内輸送受容体の構造変化を系統的に解析しました。さらに、核内輸送受容体と輸送タンパク質の核局在化ペプチドとの相互作用様式を変異体を用いたGSTプルダウンアッセイ及び表面プラズモン共鳴法によって解析し、核内輸送受容体による細胞質から核内へのタンパク質の輸送機構を世界で初めて実験的に明らかにしました。
この研究成果は10月12日発行の米国の科学雑誌「Molecular Cell」に掲載されました。
Tsuyoshi Imasaki, Toshiyuki Shimizu, Hiroshi Hashimoto, Yuji Hidaka, Shingo Kose, Naoko Imamoto, Michiyuki Yamada, and Mamoru Sato : Structural basis for substrate recognition and dissociation by human transportin 1. Molecular Cell, 28, 57-67, (2007).
SPring-8プレスリリース
http://www.spring8.or.jp/ja/current_result/press_release/2007/071012
横浜市立大学トピックス
http://www.yokohama-cu.ac.jp/res/researcher/info/071016_sato.html
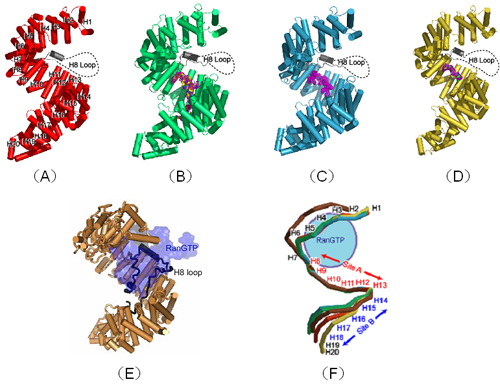
| ヒト由来のトランスポーチンの立体構造。 (A)トランスポーチン単体。 (B)〜(D)トランスポーチンと各種荷札(核局在化ペプチド)との複合体。 (E)トランスポーチンとRanGTPとの複合体(Chook & Blobel, 1999)。 (F)上記(A)から(E)のトランスポーチン部分の構造比較。 |
by pfw3-admin@pfiqst.kek.jp